鸟枪法蛋白质组学分析是目前最有前途的单细胞蛋白质测序技术,但其每细胞约1000个蛋白质的鉴定水平仍不足以用于实际应用。
2024年2月10日,浙江大学方群团队在Nature Communications 发表题为“pick-up single-cell proteomic analysis for quantifying up to 3000 proteins in a Mammalian cell”的研究论文,本研究开发了一种单细胞蛋白质组学分析 (PiSPA)工作流程,以实现对哺乳动物细胞中多达3000个蛋白质组的深度鉴定。
PiSPA工作流程是专门针对单细胞样品建立的,主要基于纳升级微流控液体处理机器人,能够在拾取操作策略下实现单细胞捕获、预处理和进样。在DIA (MBR)模式下,在单个A549细胞(n= 37)、HeLa细胞(n=44)和U2OS细胞(n=27)中分别定量2449-3500、2278-3257和1621-2904组蛋白质。得益于其灵活的细胞采集能力,研究者在单细胞蛋白质组水平上研究了HeLa细胞的迁移,展示了单细胞视角在实际生物学研究中的潜力。

如今,单细胞基因组和转录组学技术已经发展得很好。然而,单细胞蛋白质组学技术的发展面临重大技术挑战,因为单细胞中的蛋白质含量极低,蛋白质难以作为核酸扩增。到目前为止,已经开发了多种单细胞水平的蛋白质分析技术。目前基于质谱的蛋白质组学分析技术中,采用自下而上策略的鸟枪技术通常具有最大的蛋白质鉴定深度和广度。因此,近年来,基于鸟枪法的多种单细胞蛋白质组分析方法被开发出来。
典型的单细胞鸟枪法蛋白质组学分析过程包括从大量样品细胞中分选靶细胞、单细胞样品的预处理、液相色谱进样和ESI-MS/MS检测消化肽。对于蛋白质量极小的单细胞样品,如果使用微升级反应器进行上述一系列样品预处理操作,在样品预处理和转移过程中会出现明显的样品丢失,这会大大减少蛋白质鉴定的数量,从而严重限制单细胞蛋白质组学的鉴定深度。
为了突破单细胞蛋白质组学鉴定深度的障碍,解决上述挑战的一种策略是在纳升级原位微反应器中进行样品预处理。与常规实验室中使用的常规微升级反应器相比,这些微反应器体积减少了数百倍,可以避免微量单细胞样品的过度稀释,有效提高反应效率,减少预处理过程中样品组分吸附在反应器表面造成的样品损失。利用串联质谱标签(TMT)技术,从单个急性髓系白血病(AML)细胞中定量了多达1500种蛋白质。然而,大多数已报道的纳米级微反应器需要使用微加工芯片或器件作为微反应器,并且需要特殊的样品注入装置和额外的操作来完成纳米级体积样品的注入。
目前,一个重要的新兴趋势是开发能够集成全程操作的单细胞蛋白质组学平台,以促进单细胞蛋白质组学分析的实用性和普及性。尽管在单细胞蛋白质组学方面取得了重大进展,但如何进一步提高蛋白质鉴定深度,同时简化设备和操作,实现单细胞水平的实用全过程蛋白质组学分析,仍存在巨大挑战。该研究开发了用于单细胞蛋白质组学分析的整体工作流程解决方案。能够在单个哺乳动物细胞中实现多达3000个蛋白质组的深度鉴定。通过使用基于探针的微流控液体处理机器人,结合商品化的液相色谱(LC)和捕获离子迁移谱(TIMS) QTOF质谱仪,实现了更自动化和更方便的操作。在PiSPA工作流程中,采用基于毛细管探针的自动化取肽操作模式,将细胞蛋白在纳升反应器中消化成多肽,并将多肽样品注入LC柱。
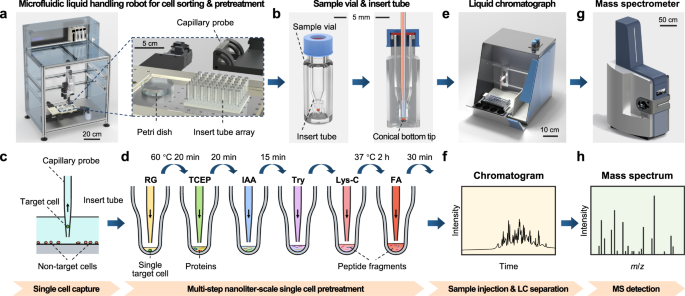
用于单细胞蛋白质组学分析的PiSPA工作流程示意图(图源自Nature Communications )
该研究采用单细胞定制策略,充分考虑了单细胞与大体积细胞的独特特性对样品预处理、分离和检测的影响,建立了贯穿于PiSPA工作流程的一系列措施。这种策略使得单细胞分析中蛋白质鉴定的深度比以往文献报道的要深得多。研究将该平台应用于HeLa、A549和U2OS三种哺乳动物细胞的单细胞蛋白质组学分析,以及迁移HeLa细胞的单细胞蛋白质组学研。
参考消息:https://doi.org/10.1038/s41467-024-45659-4













